Ваш регион, ?
Термографические показатели эффективности АЛМАГа+ у больных с остеоартрозом коленных суставов
С. Кузьманин, Рязанский государственный медицинский университет
Ю. Бяловский, доктор медицинских наук, Рязанский государственный медицинский
университет
С. Булатецкий, доктор медицинских наук, Рязанский государственный медицинский
университет
Е. Глушкова, Клинический госпиталь Медико-санитарной части МВД России по Рязанской
области

![]() Материал
и методы
Материал
и методы
![]() Результаты
и обсуждение
Результаты
и обсуждение
Проведено исследование, целью которого явилось изучение термографической оценки эффективности магнитотерапии суставного синдрома при остеоартрозе (ОА). По результатам исследования показано, что согласно термографическим данным, при включении в состав комплексной терапии ОА коленных суставов магнитотерапии существенно повышается эффективность лечения.
О стеоартроз (ОА) является одной из серьезных медицинских проблем, что обусловлено его широкой распространенностью, высоким риском развития ограничений функции опорно-двигательного аппарата, которые приводят к нарушению трудоспособности и снижению качества жизни пациентов.
На долю ОА приходится около 40–45% всех заболеваний опорно-двигательного аппарата. По данным популяционных исследований, распространенность ОА колеблется от 4,2 до 22,6% [1, 2]. Указанные показатели существенно выше среди лиц старших возрастных групп [3, 4], в связи с чем нельзя не согласиться с Н. Bob и соавт. [5] в том, что увеличение численности населения пожилого возраста приводит к повышению распространенности ОА, что означает серьезные медицинские и социально-экономические проблемы.
Термином ОА обозначают хроническое прогрессирующее полиэтиологическое заболевание суставов, которое характеризуется дегенерацией хряща, структурными изменениями субхондральной кости, а также явным или скрытым умеренно выраженным синовитом [6]. Часто обсуждаемое заболевание обозначают как остеоартрит, мотивируя это ногочисленными данными о роли воспаления в патогенезе заболевания [5, 7–9].
Патогенез ОА сложен и многогранен. Однако сегодня большинство экспертов поддерживают точку зрения, что деградация суставного хряща, перестройка субхондральной кости и воспаление являются ключевыми патогенетическими механизмами при ОА [10, 11].
У конкретного больного могут преобладать те или иные патогенетические факторы, что обусловливает особенности клинических проявлений заболевания (фенотип). Так, при наличии выраженного синовита говорят о воспалительном фенотипе ОА [5].
Клиническая картина ОА определяется его локализацией, числом вовлеченных в процесс суставов, тяжестью их поражения, длительностью заболевания и индивидуальным порогом болевой чувствительности пациента. Заболевание обычно начинается исподволь.
Нередко ОА протекает бессимптомно даже при наличии существенных рентгенологических изменений в суставах. Наиболее частым первым проявлением заболевания является непостоянная боль в суставе, возникающая во время или сразу после нагрузки на него.
Боль при ОА имеет так называемый механический ритм, возникает обычно через некоторое время после начала физической нагрузки, реже – сразу при движении (стартовая боль). Боль, как правило, сохраняется в течение нескольких часов после прекращения нагрузки. На более поздних стадиях заболевания болевые ощущения присутствуют в покое, во время ночного отдыха, усиливаясь при движении [6].
Болевые ощущения носят иной характер при развитии синовита. Они становятся более постоянными, усиливаются при малейшем движении, что ограничивает функциональность сустава, сохраняются в покое, носят распирающий или жгучий характер, усиливаются при пальпации [5]. У большинства больных наблюдается утренняя (стартовая) скованность продолжительностью ≤10–30 мин. При выраженном синовите определяется дефигурация сустава, повышение температуры кожи над ним, реже – гиперемия, а также симптомы, характерные для скопления жидкости в полости сустава.
Диагностика ОА базируется, в первую очередь, на оценке клинических симптомов заболевания и рентгенологических данных. В последние годы в диагностике ОА используют другие методы исследования – как инвазивные (артроскопия, биопсия синовиальной оболочки), так и неинвазивные (ультрасонография, термография, сцинтиграфия, компьютерная рентгеновская и магнитно-резонансная томография) [5, 6, 12]. При формулировке диагноза учитываются локализация процесса, рентгенологическая стадия, степень функциональных нарушений. Однако в настоящее время отсутствуют критерии, отражающие степень активности воспалительного процесса в суставах при ОА.
Ранее в ряде работ показано, что осуществление комплексной терапии ОА экономически целесообразно проводить с включением магнитотерапии [13, 14]. Поэтому представляет интерес изучение влияния включения магнитотерапии в схему комплексной терапии ОА.
Целью исследования явилось изучение возможности термографической оценки эффективности магнитотерапии суставного синдрома при ОА коленных суставов (КС) с учетом важной роли магнитотерапии в лечебной тактике ОА.
МАТЕРИАЛ И МЕТОДЫ
Проведено рандомизированное двойное слепое проспективное контролируемое исследование. Основную группу составили 57 пациентов с ОА КС, среди которых было 46 женщин и 11 мужчин (средний возраст – 61,2±7,4 года). Диагноз устанавливался в соответствии с клинико-рентгенологическими критериями Американской коллегии ревматологов [13]. В исследование не вошли пациенты с тяжелыми поражениями других органов и систем, способными повлиять на результаты исследования, клинически значимыми симптомами других ревматических заболеваний, определенной коллатеральной или крестообразной нестабильностью в КС, фиксированными сгибательными деформациями КС (>10°) и (или) выраженными деформациями суставов (угол Q>10°).
Больные были рандомизированы на 2 группы: в 1-й (n=29) использовался физиотерапевтический аппарат для лечения бегущим импульсным магнитным полем (БИМП), во 2-й (n=28) – аппарат плацебо, по внешнему виду и конструкции не отличающийся от такового для лечения БИМП. Единственным отличием аппарата плацебо было отключение генератора от индукторов электромагнитного излучения во время сеанса воздействия. В качестве магнитотерапевтического аппарата использован АЛМАГ+. Режим работы – 1 (основной), воздействие осуществлялось ежедневно на область пораженного КС путем оборачивания ленты излучателей вокруг сустава; aмплитуднoе знaчение мaгнитнoй индукции нa paбoчей пoвеpxнocти кaтушкииндуктopa кaтушечнoй гpуппы aппapaтa cocтaвляло 20±6 мТл. Базисная медикаментозная терапия пациентов 2 групп не различалась. Продолжительность исследования составила 21 день. Всем больным до начала терапии и после лечения было проведено комплексное клиническое и инструментальное обследование.
Для оценки выраженности боли в суставах нами была использована визуальная аналоговая шкала (ВАШ), а для более углубленного изучения особенностей симптомов ОА, связи их с определенными видами деятельности пациента, характеристики функциональных нарушений – анкета для определения альгофункционального индекса Lequesne и опросник Western Ontario and McMaster Universities (WOMAC) [16–18].
Наличие и выраженность синовита КС клинически оценивались в баллах с использованием индекса Ричи (ИР) [6]. Для оценки функционального состояния суставов определялся функциональный класс (ФК) по классификации О. Steinbrocker [19]. Рентгенография КС осуществлялась по стандартной методике в переднезадней и боковой проекциях. Рентгенологическая стадия ОА устанавливалась по классификации, предложенной J. Kellgren и J. Lawrence [20]. Всем больным было проведено ультразвуковое исследование (УЗИ) КС на аппарате Sonoline-SL1 (Siemens, Германия) с использованием конвексного и секторного датчиков по стандартной методике [6, 12]. При этом оценивались наличие и выраженность выпота в полость сустава, изменения синовиальной оболочки, особенности поверхности и структуры суставного хряща, свойства капсулы и связочного аппарата сустава. Для осуществления термографии КС был использован портативный ИК термограф «ИРТИС 2000 МЕ», ИК-камера которого представляет собой прецизионный оптикомеханический сканер с высокочувствительным ИК-приемником [21, 22].
Математическая и статистическая обработка полученных данных осуществлялась с использованием параметрических и непараметрических методов статистики при помощи компьютерной программы Statistica (Statsoft Inc., 2009).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам проведенного обследования выявлено, что изолированное поражение КС наблюдалось у 25 (44,2±5,6%) больных, у остальных пациентов, наряду с коленными, в процесс вовлекались другие суставы.
Средний уровень боли в КС по ВАШ составил 69,0±1,1 мм (от 34 до 88 мм), а по WOMAC – 73,2±0,9 мм (от 42,3 до 96,5 мм). Продолжительность утренней скованности составила 9,7±0,7 мин, а показатель скованности в суставах по WOMAC – 41,5±1,4 мм. Припухлость суставов не определялась (ИР=0) у 22 (38,2±3,7%) пациентов, ИР=1 наблюдался у 21 (37,2±2,9%), ИР=2 – у 12 (21,4±1,8%), а ИР=3 – у 2 (5,7±1,9%) больных.
Среди пациентов преобладали лица – 41 (73,1±3,5%) человек, у которых функциональные нарушения по O. Steinbrocker соответствовали II функциональному классу (ФК), у 12 (21,02±3,3%) – I ФК, у 3 (5,1±1,8%) больных – III ФК. Из исследования были исключены лица, функциональные нарушения у которых соответствовали IV ФК. Показатель ограничения повседневной активности пациентов по WOMAC составил 51,0±1,2 мм, а индекс Lequesne – 9,1±0,4 балла. Среди обследованных преобладали лица с ОА II рентгенологической стадии – 42 (75,2±3,4%) человека; ОА I и III стадии наблюдался соответственно у 7 (12,7±2,7%) и 7 (12,1±2,6%) больных. Пациенты с ОА IV стадии в нашем исследовании отсутствовали.
Изменения, выявленные при УЗИ КС, приведены в табл. 1.
Таблица 1: Ультразвуковые изменения КС у больных ОА
| Показатель | Число больных | М±m,% |
|
Выпот в полость сустава: умеренный значительный |
42 29 13 |
75,8±3,4 51,6±3,9 24,2±3,4 |
| Киста Бейкера | 2 | 3,8±1,5 |
| Утолщение синовиальной оболочки | 34 | 59,9±3,9 |
| Васкуляризация хряща | 18 | 31,9±3,7 |
| Паракапсулярный отек хряща | 22 | 39,5±3,9 |
| Неоднородность суставного хряща | 54 | 96,7±1,4 |
| Разволокнение связочного аппарата | 46 | 82,8±3,0 |
Данные клинических и инструментальных исследований у пациентов с ОА были подвергнуты корреляционному анализу с определением показателя ранговой корреляции Спирмена. Проведено сопоставление показателей возраста, пола, индекса массы тела (ИМТ), длительности заболевания, уровней боли по ВАШ и WOMAC, продолжительности утренней скованности, выраженности утренней скованности по WOMAC, ФК, степени ограничения повседневной активности по WOMAC, индекса Lequesne, рентгенологической стадии, ультразвуковых параметров, типов термограмм.
Как следует из данных, приведенных в табл. 2, не выявлено корреляционных связей ни одного из анализируемых параметров с полом и ИМТ (р<0,28). Возраст больных коррелировал только с длительностью заболевания (р=0,955), рентгенологической стадией ОА (р=0,518), ФК (р=0,516), индексом Lequesne (р=0,418), показателем ограничения повседневной активности по WOMAC (р=0,529) и уровнями боли по ВАШ (р=0,405) и WOMAC (р=0,427). Аналогичные связи выявлены между длительностью заболевания и рентгенологической стадией (р=0,519), ФК (р=0,517), индексом Lequesne (р=0,521), показателем ограничения повседневной активности по WOMAC (р=0,531) и уровнями боли по ВАШ (р=0,407) и WOMAC (р=0,428). Корреляционные связи выявлены между рентгенологической стадией ОА и ФК (р=0,549). Установлено, что возраст, длительность заболевания и рентгенологическая стадия не коррелировали с другими клиническими и ультразвуковыми показателями (р<0,4).
Установлена положительная корреляционная связь уровня боли по ВАШ и WOMAC с такими показателями, как ограничение повседневной активности, определяемой по WOMAC, индекс Lequesne, ФК, ИР, продолжительность утренней скованности и ее выраженность по WOMAC, типом термографии, а также данными УЗИ (см. табл. 2).
Таблица 2: Корреляционные связи уровней боли в суставах по ВАШ и WOMAC у больных ОА
| Показатель | Коэффициент корреляции (р) | |
| уровень боли по ВАШ | уровень боли по WOMAC | |
| Ограничение повседневной активности по WOMAC | 0,709 | 0,741 |
| Индекс Lequesne | 0,68 | 0,677 |
| ФК | 0,585 | 0,580 |
| ИР | 0,563 | 0,547 |
| Продолжительность утренней скованности | 0,643 | 0,630 |
| Выраженность скованности по WOMAC | 0,674 | 0,667 |
| Тип термограммы | 0,549 | 0,558 |
| Выпот в полость сустава | 0,602 | 0,604 |
| Утолщение синовиальной оболочки | 0,395 | 0,417 |
| Васкуляризация хряща | 0,485 | 0,477 |
| Разволокнение связочного аппарата | 0,306 | 0,312 |
| Паракапсулярный отек хряща | 0,428 | 0,431 |
Из табл. 2 видно, что сильные корреляционные связи имеются между показателями интенсивности боли, продолжительностью и выраженностью утренней скованности.
Кроме того, интенсивность боли в суставах коррелирует с показателями ограничения функциональных возможностей пациента (индексом Lequesne, показателем ограничения повседневной активности по WOMAC, ФК). Такие ультразвуковые показатели, как киста Бейкера и неоднородность суставного хряща, не имели корреляционных связей с уровнями боли в суставах (р<0,1).
Выявлена устойчивая корреляционная связь между типом термографической картины околосуставных тканей и выраженностью боли по ВАШ (р=0,846) и WOMAC (р=0,863). Таким образом, метод инфракрасной термографии можно использовать как инструментальный диагностический метод, отражающий степень воспалительного процесса в КС.
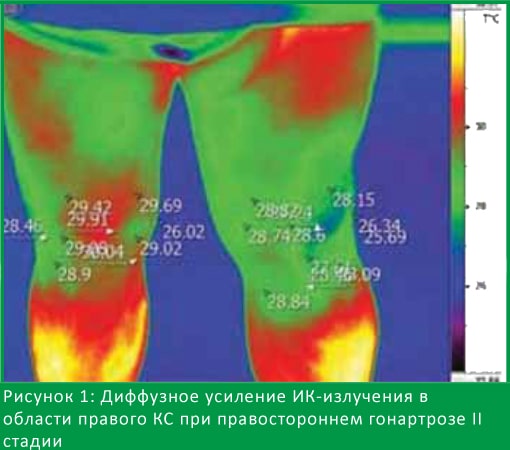
При термографическом исследовании у больных с ОА КС нами были получены 4 вида термограмм, что согласуется с литературными данными [20]. Для 1-го вида термограмм характерно усиление ИК-излученияпо всей области сустава. На рис. 1 представлена термограмма больного с правосторонним гонартрозом II рентгенологической стадии, где градиент разности с верхней третью голени (∆T) составляет 1,1°С.
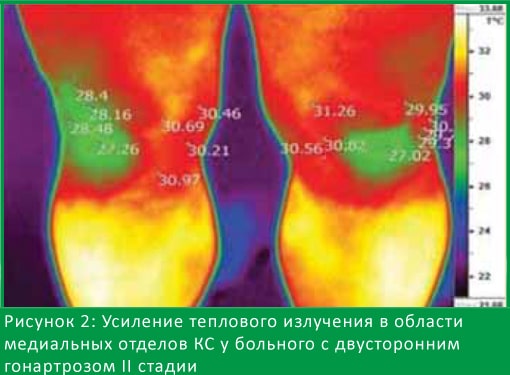
При 2-м типе термограмм наблюдалось усиление теплового излучения по боковым поверхностям КС у больных гонартрозом. На рис. 2 показана термограмма больного с двусторонним гонартрозом II рентгенологической стадии, при которой наблюдается усиление теплового излучения в медиальных отделах КС, очаги гипертермии имеют ровные четкие контуры, ∆T составляет 1,6°С.
При 3-м типе термографическая картина представляла собой участки усиления ИК-излучения с неровными контурами в латеральных и медиальных отделах КС.
На рис. 3 представлена термограмма больного с двусторонним гонартрозом II рентгенологической стадии, где видны участки с неровными и нечеткими контурами, от которых исходит повышенное ИК излучение с ∆T справа 1,3°С, слева – 0,8°С.
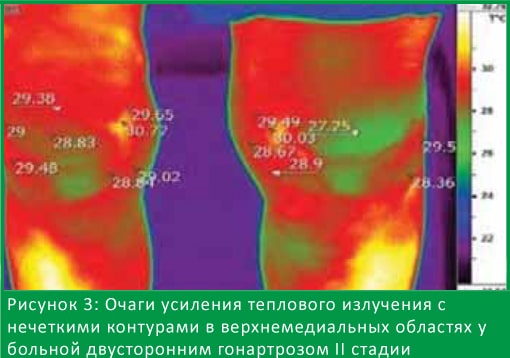
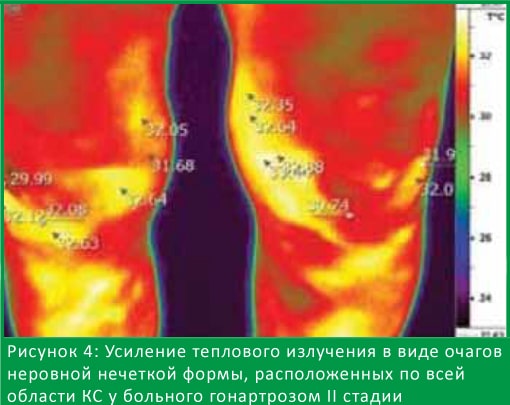
На 4-м типе термограмм мы выявили неоднородные очаги инфракрасного излучения, очаги гипертермии разной формы с четкими и нечеткими контурами.
На рис. 4 видны участки с неровными нечеткими контурами по всей области КС, перепад температур составляет 1,9°С. Данный вид термограмм выявлен только у больных с сочетанным течением гонартроза II cтадии и метаболического синдрома.
Как видно из табл. 3, температура кожи значительно отличается в двух основных группах больных (получавших и не получавших магнитотерапию) с разными рентгенологическими степенями ОА. Отмечено, что чем больше тяжесть ОА, тем более выражены термометрические признаки воспаления сустава.
Таблица 3: Динамика показателей термографии в ходе курсового лечения ОА у больных, получавших (1-я группа) и не получавших (2-я группа) магнитотерапию; Т, °
| Стадия ОА | 1-я группа | 2-я группа | ||
| до лечения | после лечения | до лечения | после лечения | |
| I | 36,90±0,21* | 36,30±0,12* | 36,90±0,32* | 36,60±0,3* |
| II | 37,70±0,05** | 35,70±0,12** | 37,50±0,17* | 36,70±0,25* |
| III | 37,60±0,35** | 36,40±0,2** | 37,30±0,49* | 36,90±0,39* |
|
Примечание. Достоверность различий: * – р>0,05; ** – р<0,05. |
||||
При этом существенное значение имеет включение в состав комплексной терапии гонартроза магнитотерапии. Так, до лечения в 1-й группе больных ОА III стадии динамика снижения температуры сустава обследуемой конечности при курсовом лечении составила 1,2°С (р>0,05); во 2-й – меньше – 0,4°С (р>0,05). В 1-й группе больных ОА II стадии снижение температуры суставов на фоне курсового лечения составила 2°С (р>0,05), во 2-й – существенно меньше (0,8°С; р>0,05). Таким образом, включение в состав комплексной терапии ОА магнитотерапии существенно повышает эффективность лечения по термографическим данным. Учитывая, что термография в первую очередь отражает выраженность воспаления сустава при ОА, следует отметить эффективность магнитотерапии именно в лечении суставного синдрома при ОА.
У больных ОА I рентгенологической стадии динамика термографических данных у больных 1-й и 2-й групп не обнаруживалась (р>0,05), что свидетельствует о незначительной выраженности воспаления сустава у больных ОА I стадии.
Оценивая термографические критерии суставного синдрома у больных ОА, следует отметить, что наиболее выраженные изменения в состоянии терморегуляции суставов наблюдается в группе больных ОА II стадии. При этом набольшая динамика нормализации температурного баланса суставов отмечалась в группе больных ОА при сочетании базисной медикаментозной терапии с курсовым лечением БИМП.
В меньшей степени эффективность магнитотерапии по термографическим критериям отмечалась у больных ОА III стадии, хотя у представителей этой группы отмечен достоверный и отчетливый эффект магнитотерапии. Наконец, минимальная эффективность магнитотерпии по данным термографии отмечалась у больных ОА I рентгенологической стадии, что указывает на низкую выраженность воспалительного суставного синдрома.
По результатам изложенного сделаны следующие выводы:
![]() метод
инфракрасной термографии можно использовать как диагностическую методику, отражающую степень активности
воспалительного процесса в суставах при ОА;
метод
инфракрасной термографии можно использовать как диагностическую методику, отражающую степень активности
воспалительного процесса в суставах при ОА;
по термографическим данным, при включении в состав комплексной терапии ОА КС магнитотерапии повышается эффективность лечения;
наибольшая динамика нормализации температурного баланса суставов отмечалась в группе больных ОА КС I и II рентгенологических стадий при сочетании базисной медикаментозной терапии с курсовым лечением БИМП при помощи аппарата АЛМАГ+;
адекватная оценка суставного синдрома у конкретного больного, по нашему мнению, позволит осуществлять индивидуальный подход к выбору тактики лечения, точно оценивать его эффективность, повысить приверженность больного лечению и снизить риск развития побочных эффектов.
Литература:
-
Коваленко В.Н., Борткевич О.П. Остеоартроз. Практическое руководство / Киев: Морион, 2003; 448 с.
- Zhang W., Doherty M., Arden N. et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann. Rheum. Dis. – 2005; 64: 669–81.
- Mannoni A., Briganti V., Di Bari M. et al. Epidemiological profile of symptomatic osteoarthritis in older adult: a population based study in Dicomano, Italy // Ann. Rheum. Dis. – 2003; 62: 576–8.
- Bijlsma J. Patient centred outcomes in osteoarthritis // Ann. Rheum. Dis. – 2005; 64: 1–2.
- Bob H., Sun M., Christopher W. et al. New developments in osteoarthritis // Rheum. Dis. Clin. N. Am. – 2007; 33: 135–48.
- Насонов Е.Л., Насонова В.А. Ревматология / М.: Медицина, 2008; 652 с.
- Abramson S. Inflammation in osteoarthritis // J. Reumatol. – 2004; 31: 70–6.
- Conaghan P., D'Agostino M., Ravaud P. et al. EULAR report on the use of ultrasonography in painful knee osteoarthritis. Part 2: Exploring decision rules for clinical utility // Ann. Rheum. Dis. – 2005; 64: 1710–4.
- D'Agostino M., Conaghan P., Le Bars M. et al. EULAR report on the use of ultrasonography in painful knee osteoarthritis. Part I: Prevalence of inflammation in osteoarthritis // Ann. Rheum. Dis. – 2005; 64: 1703–9.
- Benito M., Veale D., FitzGerald O. et al. Synovial tissue inflammation in early and late osteoarthritis // Arthritis Reum. – 2005; 64: 1263–7.
- Buckwalter J., Lotz M., Stoltz J. (Eds.) Osreoarthtritis, inflammation and degradation: a continuum / Amsterdam, Berlin, Oxford, Tokyo, Washington, DC: IOS Press, 2007; 299 p.
- Keen H., Lavie F., Wakefield R. et al. The development of a preliminary ultrasonographic scoring system for features of hand osteoarthritis // Ann. Reum. Dis. – 2008; 67: 651–5.
- Бодрова А.И., Бяловский Ю.Ю., Иванов А.В., и др.. Экономическая целесообразность включения магнитотерапии в комплексное лечение остеоартроза // Врач. – 2014; 4: 59–63.
- Бяловский Ю.Ю., Иванов А.В., Ракита Д.Р. Оптимизация магнитотерапевтического воздействия при лечении остеоартроза // Врач. – 2016; 3: 75–8.
- Altman R., Asch E., Bloch D. et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the knee // Arthritis Rheum. – 1986; 29: 1039–49.
- Lequesne M. The algofunctional indices for hip and knee osteoarthritis // Rheumatology. – 1997; 24: 779–81.
- Bischoff-Ferrari H., Vondechend M., Bellamy N. et al. Validation and patient acceptance of a computer touch screen version of the WOMAC 3.1 osteoarthritis index // Ann. Rheum. Dis. – 2005; 64: 80–4.
- Tubach F., Baron G., Falissard B. et al. Using patients' and rheumatologists' opinions to specify a short of the WOMAC function subscale // Ann. Rheum. Dis. – 2005; 64: 75–9.
- Steinbrocker O., Traeger C., Batterman R. Therapeutic criteria in rheumatoid arthritis // JAMA. – 1969; 140: 659–62.
- Kellgren J., Lawrence J. Radiological assessment of osteoarthrosis // Ann. Rheum. Dis. – 1957; 16: 494–501.
- Голованова М.В., Потехина Ю.П. Возможности термодиагностики в медицине / Н. Новгород, 2011; 164 с.
- Мельникова В.П. и др. Клиническое тепловидение / СПб: ГОИ им. С.Ю. Вавилова, 1999; с. 116–7.
Источник: Ежемесячный научно-практический и публицистический журнал "Врач" №10, 2018